El gen humano, además de contener información que da forma a la estructura de nuestro organismo y por ende, nuestra apariencia física, también puede proveer indicios de las propensiones del ser humano hacia ciertas enfermedades que pueden ser mortales sin una prevención temprana en sus fases de desarrollo.
Así, el estudio de estos componentes por parte de la genómica está permitiendo el surgimiento de la denominada “medicina personalizada” que, si bien aún se encuentra en una etapa bastante prematura, promete ofrecer tratamientos acordes a la realidad genética de cada paciente, superando aquellas soluciones genéricas hacia las enfermedades ofrecidas por la medicina tradicional.
En un reciente artículo publicado por The Economist, que compartimos líneas abajo, se describen brevemente los avances que ha logrado la ciencia en torno a la medicina personalizada y los riesgos que enfrentaría su posterior consolidación, como es el exceso de información que podría incitar a las personas al pánico, al tratamiento excesivo o a la automedicación.
Es importante conocer los pros y contras de estos procesos innovadores en la medicina y evaluar la conveniencia de ser adoptados progresivamente por nuestro país en un futuro cercano. Ello teniendo en cuenta que el Perú, con las herramientas de la medicina tradicional, no se encuentra enfrentando desde su sistema público, provechosamente su crisis de salud. Lampadia
Medicina personalizada
La medicina se está enfrentando a la individualidad
Sus genes, entornos y actividades hacen que las personas sean diferentes
The Economist
12 de marzo, 2020
Traducida y comentada por Lampadia
Neena Nizar tiene 42 años, es profesora de estudios de negocios y solo mide 1.22 cm de alto. Los extremos de sus huesos son suaves y flexibles: en una radiografía se ven deshilachados, como pinceles viejos. Durante su infancia y adolescencia en Dubai fue operada 30 veces. La fuente de su problema seguía siendo un misterio. En 2010, después de tres décadas de preguntas, finalmente recibió un diagnóstico: la condrodisplasia metafisaria de Jansen, una afección reconocida por primera vez en la década de 1930. Sus problemas provienen de una copia rota de solo uno de sus 20,000 genes.
La Dra. Nizar es de alguna manera muy inusual. Menos de una de cada 200 millones de personas tiene la mutación en el gen PTH1R que causa la enfermedad de Jansen. En otros sentidos, ella es como todos los demás. Aunque pocas personas tienen un defecto tan debilitante, la salud y la mala salud de todos están ligadas al contenido de sus genomas. Todos los genomas contienen arreglos de genes que producen trastornos psicológicos, cánceres, demencias o enfermedades circulatorias, ya sea más un problema o menos de uno. Todos tienen genes que los hacen mejores o peores en la metabolización de las drogas, más o menos propensos a beneficiarse de formas específicas de ejercicio, más capaces de digerir algunos alimentos que otros.
El mismo arreglo nunca se verá dos veces. Aunque para gemelos idénticos las diferencias son el colmo de la sutileza, cada uno de los 7,500 millones de genomas humanos que comparten el planeta es único. Esa diversidad irreducible representa un desafío para muchos de los mayores avances médicos del siglo XX, que se basaron en un enfoque único para todos. Personalizar la medicina es una oportunidad atractiva para mejorar.
Los buenos médicos siempre han tratado a sus pacientes como individuos. En los análisis de sangre del siglo XX, las radiografías, los escáneres corporales y otras herramientas de diagnóstico hicieron cada vez más visibles los detalles de los problemas particulares de cada paciente. Una reducción espectacular en el costo de lectura, o secuenciación, de las «bases» de ADN que componen la información genética humana está agregando un nuevo nivel de individualidad. Ahora es posible inspeccionar las diferencias genéticas con una facilidad previamente inimaginable y, por lo tanto, saber algo sobre las propensiones a la enfermedad mucho antes de que aparezcan los síntomas.
Nadie sabe exactamente cuántos genomas humanos se han secuenciado por completo, y los diferentes procedimientos de secuenciación leen el genoma en diferentes grados: hay descremas rápidas y estudios filológicos minuciosos. Pero el número está en millones. Para la década de 2030, es probable que la secuenciación del genoma sea tan rutinaria en algunos lugares como tomar hoy un pinchazo de sangre del talón de un bebé; incluso puede ser parte del mismo procedimiento. La ciencia del genoma se está convirtiendo en una cuestión de medicina práctica. Están llegando al mercado nuevas terapias que permiten ajustar o editar esta herencia genética.
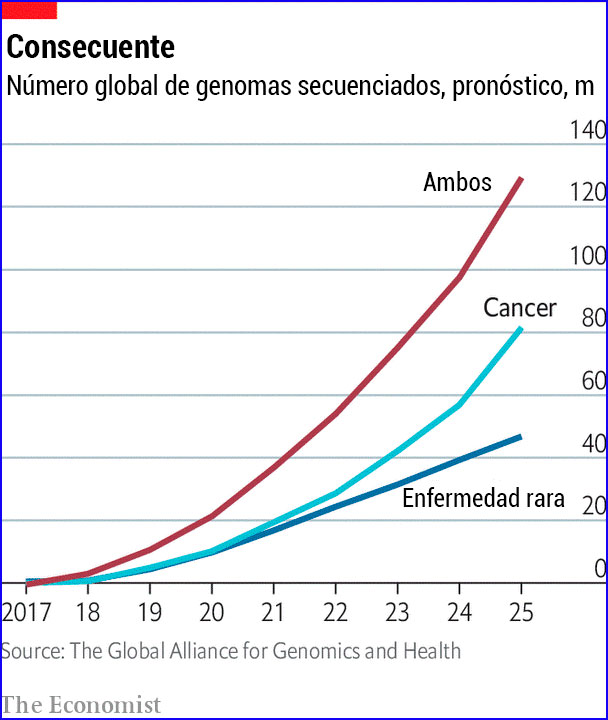
Esta avalancha de datos permite que la medicina se vuelva más precisa y más personal; en muchos sentidos, las palabras p son dos caras de la misma moneda. Las enfermedades genéticas previamente reconocidas, como la de Jansen, se han rastreado a genes específicos y se pueden conectar a defectos en las proteínas que crean (casi todos los genes describen proteínas, y las proteínas realizan casi todo el trabajo químico del cuerpo). La mayoría de estas enfermedades son raras, ya que generalmente no afectan a más de una persona de cada 2,000 en la población general. Pero con más de 6,000 enfermedades tan raras ahora reconocidas, esto significa que son comunes en conjunto. En Gran Bretaña, una de cada 17 personas puede esperar sufrir una enfermedad rara en algún momento.
Los estudios de enfermedades genéticas no son solo un fin valioso en sí mismos. Comprender qué sale mal cuando una proteína específica está fuera de control puede revelar información básica sobre el funcionamiento del cuerpo que puede ser útil para tratar otras dolencias. Y la creciente comprensión de cómo grandes conjuntos de genes pueden contribuir a la enfermedad está haciendo posible elegir a los pacientes con mayor riesgo de enfermedades comunes como diabetes, afecciones cardíacas y cáncer. Eso ayudará a los médicos a personalizar sus intervenciones. En teoría, el aumento en el acceso a la información genética personal permite a los individuos calcular mejor estos riesgos y tomar medidas preventivas. En la práctica, hasta ahora, pocas personas parecen hacerlo.
La genómica no es la única fuente de nuevos datos de salud personal. Así como todos los genomas son únicos, también lo son las vidas que llevan todos esos portadores de genomas. El aumento en otras formas de datos sobre individuos, ya sea en otra información molecular de pruebas médicas, registros de salud electrónicos o datos digitales registrados por sensores baratos y ubicuos, hace que lo que sucede en esas vidas sea cada vez más fácil de capturar. El aumento de la inteligencia artificial y la computación en la nube permite analizar este torrente de datos.
Muévete libremente, pero no rompas las cosas
Estas posibilidades no están exentas de riesgos, inconvenientes y posibles decepciones. La capacidad de determinar qué ha fallado en un genoma no facilita su reparación. Además, a medida que la tecnología ayude a las personas a controlarse a sí mismas de más maneras, el número de «bien preocupados» aumentará y aumentará la atención innecesaria. Muchos podrían sufrir un daño real por un espejismo algorítmico.
Más allá de esto, la actitud de «moverse rápido y romper cosas» común en las empresas de tecnología se sienta incómoda con «primero, no hacer daño». Y los medios sin trabas, sin supervisión e inexplicables de acumulación de datos vistos en otras industrias que han sufrido transformaciones digitales se sienten incómodos con las preocupaciones sobre la privacidad médica.
Sin embargo, la naturaleza misma de la medicina significa que el futuro no será solo una cuestión de objetivos comerciales, culturas de investigación, destrezas tecnológicas, prácticas sensatas y regulaciones bien elaboradas. También estará sujeto a los intereses de conducción de individuos particulares de formas nunca antes vistas. El desarrollo de la investigación médica basada en genes en Gran Bretaña se vio profundamente afectado por la corta y difícil vida de Ivan Cameron, cuyo padre, David Cameron, hizo mucho por desarrollar la genómica cuando era primer ministro. Muchos de los que trabajan en este campo están impulsados por la pérdida personal.
Y luego están aquellos cuyos intereses se derivan de la forma en que sus propios genes dan forma a sus vidas. Gente como la Dra. Nizar, quien ahora está elaborando una nueva agenda de investigación para la enfermedad de Jansen. Solo puede haber 30 personas en el mundo que lo padecen. Pero dos de ellos son sus hijos, y tienen un dolor incesante. La ciencia sabe por qué; la medicina aún no puede ayudar. «Creemos en los milagros», dice ella. Ella también está trabajando para que uno suceda. Lampadia








